对着丝粒结构的新见解
由大阪大学领导的研究人员使用低温电子显微镜分析染色体着丝粒区域的原子结构,这对细胞分裂至关重要。一种叫做CENP-A的蛋白质标记着丝粒;研究人员表明,在间期,CENP-A被一种称为KNL2的蛋白质结合以维持着丝粒的位置。在有丝分裂期间,KNL2被CENP-C取代,允许正确形成用于细胞分裂的动粒复合物。
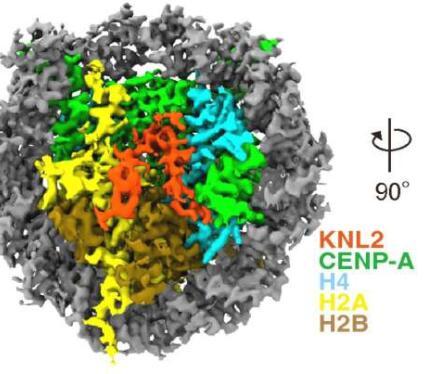
细胞内的遗传物质被组织成称为染色体的结构。当细胞分裂和生长时,着丝粒对于通过与纺锤体微管相互作用正确分裂染色体至关重要。现在,大阪大学研究人员的一项研究使用一种称为低温电子显微镜(cryo-EM)的技术阐明了鸡细胞中着丝粒区域的结构。
冷冻电镜快速冷冻样品以保存和稳定它们,然后使用与电子的碰撞对它们进行成像以揭示其结构。一种称为“动粒体”的蛋白质复合物在着丝粒区域形成,这对于细胞正确分裂至关重要。研究人员能够使用冷冻电镜分析在原子水平上阐明动粒的结构变化。
当DNA被浓缩成染色体时,它被盘绕在由称为组蛋白的蛋白质组成的核心周围,形成一种称为核小体的结构。着丝粒区域的核小体含有一种称为CENP-A的变异组蛋白,它指定着丝粒的位置。然而,CENP-A沉积在着丝粒以正确定义其位置的机制直到现在还未知。
研究小组表明,在有丝分裂期间,一种名为CENP-C的蛋白质结合CENP-A并充当其他动粒蛋白的支架。然而,在间期(细胞不分裂的时间),一种称为KNL2的不同蛋白质与着丝粒结合。“KNL2包含类似CENP-C的基序,是Mis18复合物的组成部分,是新CENP-A沉积的许可因素,”该研究的主要作者Honghui Jiang和Mariko Ariyoshi解释说。
研究小组进一步发现,KNL2和着丝粒之间的这种相互作用是CENP-A在相间期新沉积所必需的,这反过来又有助于维持着丝粒的正确位置。
“我们还表明CENP-C在有丝分裂过程中被磷酸化,磷酸化的CENP-C从KNL2-CENP-A复合物中排除KNL2,”资深作者Tatsuo Fukagawa解释说。这表明KNL2通过间期与CENP-A结合,保持着丝粒的位置,直到磷酸盐分子在细胞达到有丝分裂时与CENP-C结合。然后,CENP-C优先与CENP-A结合,允许形成用于细胞分裂的动粒。
这些对着丝粒区结构的新见解将被证明在推进细胞分裂和生长知识方面非常宝贵。参与细胞分裂和动粒的蛋白质是抗癌药物的靶标;因此,这项工作也将有助于设计用于癌症等疾病的新药。
免责声明:本文为转载,非本网原创内容,不代表本网观点。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。