血管周围空间的生物信息学探索发现24个基因组风险位点
一个由79名研究人员组成的国际团队合作开展了一项发表在《自然医学》上的研究,深入研究血管周围空间(PVS),这是一种在脑小血管疾病的磁共振成像中看到的鲜为人知的人工制品,是中风和痴呆的主要原因。
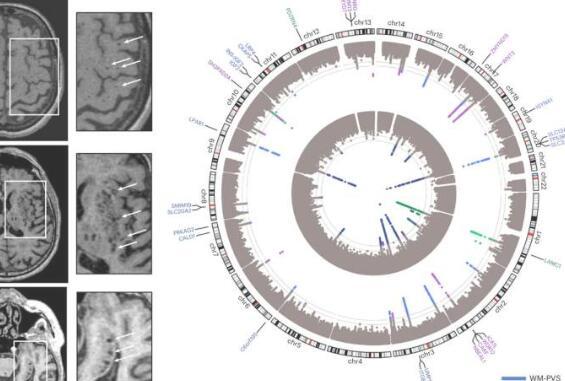
在这项研究中,“血管周围空间负担的基因组学揭示了脑小血管疾病的早期机制”,研究人员对40,095名参与者进行了一项全基因组关联研究,并在18个基于人群的队列(66.3±8.6岁,96.9%欧洲血统)中使用脑成像数据。该分析揭示了24个全基因组显着的PVS风险位点,主要在白质中。
这些位点已经与年轻成人的白质PVS相关(N = 1,748;22.1±2.3年),并富含早发性脑白质营养不良(白质异常生长)基因和胎儿脑内皮细胞表达的基因,表明早期生命机制。讨论研究结果的研究简报已在同一期刊上发表。
PVS 是围绕小血管壁的生理空间,从蛛网膜下腔穿过脑实质。在实验模型中,PVS似乎是底物输送,冲洗间质液,清除β-淀粉样蛋白肽等代谢废物的重要管道,并且作为“glymphatic系统”的一部分参与脑液调节。
越来越多的证据表明,PVS 在脑损伤、卒中和痴呆中起主要作用。在脑磁共振成像上观察到的 PVS 扩张被认为是功能障碍的标志,据推测反映了脑液和废物清除的损害。PVS的发病率随着年龄的增长和高血压等血管危险因素的增加而增加,并且与许多白质和血管相关的脑部疾病有关。
一些研究还表明,脑MRI上可见PVS的数量与中风,阿尔茨海默病和脑淀粉样血管病有关。卒中后水肿与卒中后 PVS 增大有关。
研究人员对40,095名参与者进行了一项全基因组关联研究(GWAS)荟萃分析,并对另外19,010名参与者进行了全外显子组/全基因组测序(WES / WGS)。他们分别对白质(WM)-PVS,基底神经节(BG)-PVS和海马(HIP)-PVS进行了分析。
通过收集到一个不错的数据集,生物信息学探索深入研究了组织和细胞特异性基因表达数据库以及已确定的PVS风险位点的药物靶点库。
该研究确定了24个独立的全基因组显着风险位点,用于广泛的PVS负担。三分之二的PVS风险位点指向未由既定风险因素介导的途径,并涉及细胞外基质,血脑屏障,膜运输和血管发育。
有重要证据表明高血压与PVS之间以及PVS与BG卒中之间存在因果关系。 参与早发性脑白质营养不良并在胎儿脑血管内皮细胞中表达的基因中PVS位点的显着富集表明参与发育过程和先前研究的血管和认知障碍药物靶标。
研究人员得出结论,研究结果“......深入了解PVS在整个成人生命周期中的生物学及其对脑小血管疾病病理生理学的贡献,并有可能在脑小血管疾病的预防试验中对药物靶标进行遗传知情的优先排序,脑小血管疾病是全球中风和痴呆的主要原因。
免责声明:本文为转载,非本网原创内容,不代表本网观点。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。