科学家开发模型 更有效地模拟与癌症相关的蛋白质相互作用
劳伦斯利弗莫尔国家实验室的科学家们开发了一种理论模型,用于更有效地模拟细胞膜及其脂质 - 蛋白质相互作用的分子水平,这是更好地了解致癌膜蛋白行为的多机构努力的一部分。
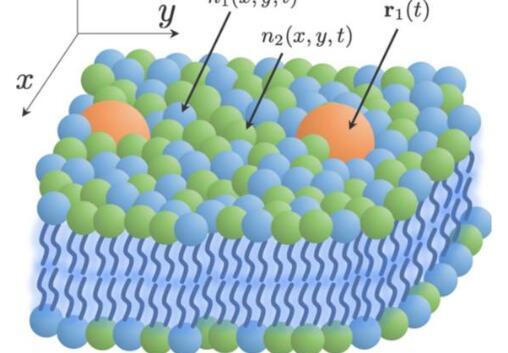
在能源部(DOE)和国家癌症研究所(NCI)正在进行的合作下开发,旨在模拟细胞膜与RAS的相互作用 - 一种突变与约30%的人类癌症相关的蛋白质 - 新模型解决了模拟RAS行为的一个主要问题,其中传统方法远远没有达到观察RAS相关癌症生物过程所需的时间和长度尺度。这项工作发表在最新一期的《物理评论研究》上。
“为了在更长的长度和时间尺度上进行模拟,我们开发了一个连续模型,其中可以牺牲空间分辨率来换取计算效率,”LLNL工作人员科学家和合著者Tomas Oppelstrup说。“该模型的新颖性主要在于能够描述任意数量的脂质种类,同时也直接从分子的微观特性中得出,这可以通过直接分子模拟进行计算。
基于动态密度泛函理论(DDFT)的新模型使模拟能够访问微米级的长度尺度和秒级的时间尺度,同时保持接近当前分子动力学(MD)模型黄金标准的分辨率。从角度来看,这些尺度在空间上比MD可以到达的尺度大数百倍,在时间上长数千倍。
合著者表示,该出版物表明,DDFT框架非常适合通过以“严格和一致的方式”结合基础分子水平物理学,将多组分细胞膜建模为连续体。
“该领域的连续体模型以前仅限于一种或两种脂质类型和脂质相互作用的现象学描述,”第一作者Liam Stanton说,他是圣何塞州立大学教授,LLNL应用科学计算中心的前科学家。
“DDFT形式主义提供了一种途径,可以在更大的长度和时间尺度上为任意数量的脂质类型保持分子尺度的准确性,这是MD模拟无法获得的。在这些尺度上,可以探索许多具有生物学相关性的新过程,看到这种新工具将为癌症研究和其他生物界提供什么将是令人兴奋的。
论文中描述的宏观模型是“连续介质动力学和粒子动力学的巧妙结合,并且直接由更精细的模拟构建而成,”该项目的首席研究员兼LLNL计算理事会战略伙伴关系副主任Fred Streitz表示。“该模型能够描述脂质驱动的蛋白质聚集等现象,并且由于其效率,研究人员能够轻松探索蛋白质排列的可能空间及其脂质环境。
该框架的开发是NCI / DOE癌症高级计算解决方案联合设计(JDACS4C)试点2项目的一部分,该项目旨在通过将机器学习(ML)和美国能源部国家实验室的高性能计算专业知识与NCI最先进的实验能力相结合,以研究膜上的RAS生物学并推进新癌症药物的发现,从而更好地了解RAS-RAF驱动的癌症发生和生长。
在该试点项目中,LLNL科学家展示了多尺度机器学习建模基础设施(MuMMI),以模拟RAS蛋白质在真实细胞膜上的行为,以及RAS-RAF蛋白质如何相互相互作用以及与膜脂质相互作用。
目标是通过下一代实验数据、模拟和预测模型加深对RAS生物学的理解。研究人员设想,RAS及其与细胞膜相互作用的模拟将导致更好的生物学知识和新的见解,从而加速RAS相关癌症的新治疗选择。
后续项目ADMIRRAL(RAS / RAF激活生命周期的AI驱动的多尺度研究)正在扩展在试点2下开发的RAS生物学建模的实质性能力,以探索更长的时间尺度并解决信号激活途径。
据研究人员称,机器学习将用于假设路径上的潜在配置,然后对其进行测试,所有这些都无需人工干预。ADMIRRAL由Streitz和NCI弗雷德里克国家癌症研究实验室的癌症研究技术项目主任Dwight Nissley共同领导LLNL。
