CAR-T细胞癌免疫疗法变得个性化
新的过继性T细胞疗法 - 其中T细胞,免疫系统的天然猎人,在体内巡逻外来对手,从癌症缠身的患者身上取回,在体外增压和扩增,然后注入到同一患者体内 - 正在改变癌症患者的前景。
自2017年CAR(嵌合抗原受体)-T细胞被美国联邦药物管理局(FDA)批准为第一个治疗白血病的修饰治疗细胞以来,已有五种类似产品获得批准,超过20,000人接受了这种改变游戏规则的免疫疗法的治疗。
CAR-T细胞被设计成携带合成的膜跨越受体分子,这些受体分子使用其朝外的部分与癌细胞上的抗原结合,其面向内部的部分通过打开强大的肿瘤细胞破坏程序来响应。然而,并非所有患者对CAR-T细胞疗法的反应都同样好,癌症免疫学家一直在试图找出是什么使它们工作良好或失败。
尽管对癌症患者的T细胞和健康个体的T细胞之间的差异有了萌芽的理解,但在CAR-T细胞制造过程中尚未考虑到这些见解。所有过程都使用类似类型的刺激与T细胞特异性激动剂和一般免疫刺激细胞因子一起产生可熔化的CAR-T细胞产物,无论原始T细胞表型的变化如何。
现在,哈佛大学Wyss生物启发工程研究所和哈佛大学约翰·A·保尔森工程与应用科学学院(SEAS)的生物工程师与由David Mooney博士领导的Dana-Farber癌症研究所(DFCI)的癌症免疫学家之间的合作已经证明,在制造过程中个性化CAR-T细胞刺激可以显着提高所得CAR-T细胞的一致性和效力 产品。
通过使用人工抗原呈递细胞模拟支架(APC-ms),研究小组能够微调T细胞刺激的水平,以匹配从白血病患者获得的T细胞的表型,并显着增强其离体和体内肿瘤清除能力。研究结果发表在Nature Communications上。
“我们表明,由来自癌症患者的T细胞制成的CAR-T细胞产品通常不如来自健康个体的CAR-T细胞产品功能,”创始Wyss核心教员Mooney说。
“使用精确可控的生物材料方法将CAR-T细胞抗原刺激剂量与患者T细胞的表型相匹配,该方法与天然抗原呈递非常相似,可以显着改善其功能。这种方法可以进一步个性化CAR-T细胞疗法,并消除当前T细胞制造中现有的不足。
Mooney还是SEAS的Robert P. Pinkas家族生物工程教授,以及Wyss研究所协调的免疫材料改善免疫治疗(i3)中心的负责人。该项目是在中心构思的,吴是其首席研究员之一。
为个性化CAR-T疗法提供关键
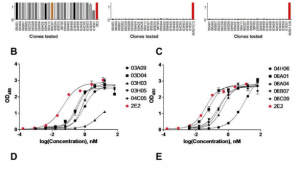
研究小组调查了他们从急性淋巴细胞白血病(ALL)和慢性淋巴细胞白血病(CLL)患者以及健康供体获得的样本中分离出的T细胞的表型。接下来,他们利用APC-MS为T细胞提供不同剂量的抗CD3 / 抗CD28抗原刺激,从而创建了一个CAR-T细胞库。
然后再次探测库中包含的所有CAR-T细胞产物的功能差异,包括它们在体外杀死癌细胞的能力。研究人员直接将他们的方法与CAR-T细胞制造中常用的方法进行了比较,后者在刚性磁珠(Dynabeads)上向T细胞呈现相同的抗原。
一个关键的发现是,癌症患者的T细胞在CAR-T细胞制造过程中常用的抗原剂量下比“健康”T细胞更容易受到过度刺激。这使得它们失去了功能,或者像免疫学家所说的那样变得更加“疲惫”,并降低了它们的增殖能力。CAR-T细胞不仅需要转化为功能状态,还需要扩增数百万,才能消除整个体内的肿瘤细胞和转移。
“通过探索APC-MS实现的精确,狭窄的刺激剂量范围,我们表明,对于患者来源的T细胞,存在一种个性化的'甜蜜点',可以最大限度地提高功能和扩增,平均而言,低于通常的剂量,”第一作者David Zhang说,他是Mooney团队的研究生。
“APC-ms方法的功能比Dynabeads更自然,因为高度可控水平的T细胞信号嵌入到脂质双层中,这使得CAR-T细胞能够推拉它们,就像T细胞通常在T细胞刺激处于最佳状态时穿过它们与抗原呈递细胞之间的'免疫突触'一样。
从体外研究到细胞制造
虽然研究小组没有观察到从ALL和CLL患者样本创建的CAR-T细胞之间有任何显着差异,但总体而言,他们的方法产生了更多对肿瘤细胞具有高细胞毒性潜力的细胞,细胞毒性CD8 T细胞和支持其功能的CD4 T细胞之间的比例更加平衡,以及更多的记忆T细胞本身没有细胞毒性,但可以在以后的反应中被激活。++
在小鼠体内研究中,用不同水平的刺激产生的输注CAR-T细胞产物也表现出显着不同的控制表达CD19的伯基特淋巴瘤的能力,在制造过程中再次以低于平时水平刺激的细胞显示出最强的潜力。
“我们构建了一个概念验证模型,该模型基于T细胞血液样本表型与其CAR-T细胞产物之间的可量化关系,并为个性化CAR-T细胞生产输出最佳T细胞刺激剂量,”Wu说。
“鉴于T细胞样本在细胞制造过程开始时总是对重要标志物进行指纹识别,因此可以设计类似的策略,以使用APC-MS方法进一步个性化治疗。Wu是DFCI预防癌症治疗的Lavine家族,也是哈佛医学院的医学教授。
“Wyss免疫材料平台的Dave Mooney团队正在使用全新的工程和基于材料的方法推动CAR-T细胞和其他免疫疗法的发展。希望这最终将使我们能够动员免疫系统对抗尚未存在治疗方法的顽固性实体瘤。这也是少即是多的一个很好的例子,“Wyss创始董事Donald Ingber说。
免责声明:本文为转载,非本网原创内容,不代表本网观点。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。