该工具针对致癌融合的弱点
圣裘德儿童研究医院的科学家全面表征了儿童癌症中的致癌融合,为基于基因工程的疗法提供了原理证明。
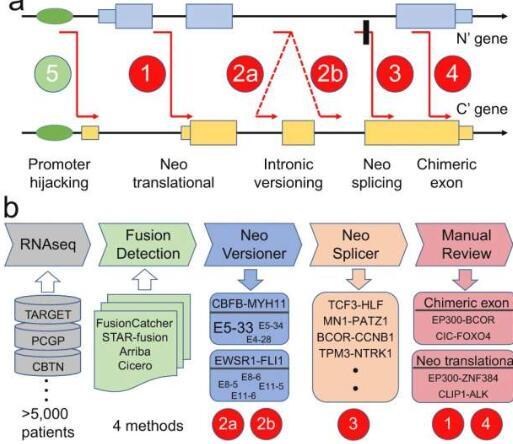
治疗一类致癌突变所需的科学基础就在这里,以圣裘德儿童研究医院的工具形式出现。圣裘德的计算生物学家对儿科癌细胞致癌融合的机制进行了全面分类和鉴定。致癌融合是驱动癌症的突变。
研究人员表明,用CRISPR等基因组编辑工具靶向它们有可能治愈某些肿瘤。研究结果今天发表在Nature Communications上。
几十年来,肿瘤学家观察到结合两个基因的突变,导致产生一种燃料癌症的杂交蛋白(融合癌基因和融合癌蛋白)。使用药物靶向融合已经显示出一些成功,因为癌细胞依赖于融合蛋白来茁壮成长。然而,这种方法一直受到困难的困扰,部分原因是缺乏对融合如何工作和治疗副作用的理解。
“我们已经制作了一些类似于化学元素周期表的东西,用于致癌融合的类型,”圣裘德计算生物学系的高级和共同通讯作者Xiaotu Ma博士说。“通过对潜在机制进行编目,我们让其他科学家能够更详细地研究聚变。
“现在已经确定融合癌蛋白驱动许多儿科癌症,”共同通讯作者Jeffery Klco,医学博士,博士,圣裘德病理学系说。“Ma实验室全面表征了儿童癌症中致癌融合的全谱,为社区提供了丰富的资源,可以挖掘以开发更具预测性的临床试验,同时还为某些肿瘤类型提出了潜在的治疗策略。这将是一项影响巨大的研究。
基因组编辑可以治愈致癌融合的原理证明
许多由致癌融合驱动的癌症的问题是它们不能用现有药物治疗。这通常是因为杂交基因产生的一种或两种正常蛋白质在健康细胞中是必不可少的。因此,给融合蛋白下药也会损害健康细胞,引起重大副作用。
但新的圣裘德工具为使用基因组编辑治疗癌症奠定了基础。导致融合基因的突变仅存在于癌细胞中。这意味着一种高度特异性的基因工程工具,如CRISPR-Cas9系统,可以选择性地切除癌细胞中的融合基因,从而消除它们制造杂交蛋白的能力,从而治愈。
“融合基因特异性序列只存在于癌细胞中,”第一作者Yanling Liu博士说,圣裘德计算生物学系。“它不会针对任何正常细胞。我们使用CRISPR-Cas9来扰乱两种癌细胞系中的融合特异性等位基因并杀死它们。
“我们能够证明使用CRISPR-Cas9和体外癌细胞系模型进行基因组编辑的治疗潜力,”共同通讯作者Shondra Pruett-Miller博士说,圣裘德高级基因组工程中心主任。“我们相信这只是冰山一角,就我们如何能够利用基因组编辑的力量来靶向这些肿瘤融合而言。
基因组编辑治疗的希望即将到来
杀死细胞系为这些癌症的基因组编辑治疗提供了原理证明。它还显示了这些治疗方法面临的困难。这些细胞系来源于目前预后不良的儿科癌症,即使经过治疗也是如此。一条线被基因组编辑简单地杀死了。
然而,另一种癌细胞系通过使用多种剪接变体意外地进行了补偿。剪接变体是源自同一DNA区域的不同RNA序列。当圣裘德科学家破坏了第二细胞系中致癌融合的所有剪接变体时,他们成功地杀死了癌细胞。
先发制人地识别剪接变异在技术上具有挑战性,目前的基因组编辑技术还不够有效,无法将这些疾病带入临床。
预测临床结果并推动研究向前发展
即使它在治疗中的使用面临挑战,计算工具已经预测了一些临床结果。圣裘德的作者能够解释为什么一小群复发性急性髓性白血病(AML)的儿科患者结局不佳。他们发现了致癌融合突变的细微差异,这比任何现有的临床诊断都更好地解释了生存结果。
结果表明,该工具可用于临床预测,这将有助于医生在未来为患者选择更加个性化和有效的治疗方法。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
【结婚需要准备的物品清单】结婚是人生中一件大事,提前做好充分的准备不仅能减轻婚礼当天的压力,还能让整个...浏览全文>>
-
【结婚胸花戴哪边】在婚礼中,胸花不仅是装饰品,更是新人形象的重要组成部分。尤其是在新娘和新郎的着装搭配...浏览全文>>
-
【结婚新娘必买清单大全结婚新娘必买清单大全都包括哪些】在筹备婚礼的过程中,新娘的准备工作往往是最繁琐也...浏览全文>>
-
【结婚新娘必买清单大全都包括哪些】婚礼是人生中最重要的时刻之一,作为新娘,在筹备过程中需要准备的物品繁...浏览全文>>
-
【结婚十一年是什么婚】在婚姻的长河中,每一个阶段都有其独特的意义和象征。结婚十一年,虽然不像“金婚”或...浏览全文>>
-
【结婚十一年经典句子推荐】结婚十一年,是婚姻中一个特别的阶段。它不再是初婚时的激情与新鲜感,而是一种深...浏览全文>>
-
【结婚十一年被称为什么婚】在婚姻生活中,不同阶段的婚姻都有其独特的名称和象征意义。结婚十一年虽然不是传...浏览全文>>
-
【酵素液的功效与作用】酵素液是一种近年来备受关注的健康饮品,因其在促进消化、增强免疫力等方面的潜在作用...浏览全文>>
-
【酵素是怎么制作的】酵素,又称酶,是生物体内一种具有催化功能的蛋白质,广泛存在于动植物和微生物中。在日...浏览全文>>
-
【酵素粉的作用与功效】酵素粉是一种近年来备受关注的健康产品,主要由多种植物、水果和蔬菜经过发酵制成。它...浏览全文>>
